هدایت الکتریکی یا کنداکتیویتی محلولها
کنداکتیوتی یا هدایت الکتریکی را میتوان معیاری برای اندازهگیری مواد معدنی موجود در آب دانست و بیش از یک قرن است که از این روش استفاده میشود. به عنوان یک روش اندازهگیری آنلاین یا اینلاین، این روش به لحاظ قیمت، مقرون به صرفه است و امکان مانیتورینگ مطمئن کیفیت آب در مراحل مختلف تصفیه را فراهم میآورد.
تکنولوژی اندازهگیری هدایت الکتریکی محلولها در طول گذار از عصر آنالوگ به عصر میکروپروسسورها تغییرات بسیاری داشته است. به همین دلیل امروزه هر هدایت سنج آنلاین و آزمایشگاهی دقت بسیار بالاتری نسبت به انواع قدیمیتر دارند و نیز از جبرانسازهای دمایی بهتری برخوردارند. در این مطلب از وبلاگ پریسماتک به بررسی هدایت الکتریکی یا کنداکتیویتی محلولها و عوامل موثر بر آن میپردازیم و سپس روش اندازهگیری کنداکتیویتی را بیان میکنیم.
هدایت الکتریکی یا کنداکتیویتی
هدایت الکتریکی توانایی یک ماده در انتقال جریان الکتریکی است. مفهوم هدایت یا کنداکتیوتی را میتوان در سایر زمینه مانند هدایت دمایی (thermal conductivity) نیز به کار برد. اما در این مطلب منظور ما هدایت الکتریکی است.
برای انتقال الکتریسیته در ماده همواره به حضور ذرات باردار نیاز است. مواد رسانا را بر اساس ماهیت ذرات باردار میتوان به دو گروه طبقهبندی کرد.
رساناهای گروه اول (معمولا فلزات) از شبکهای از اتمها با لایه بیرونی الکترون تشکیل شدهاند. الکترونها در این ابر الکترونی میتوانند آزادانه از اتمهایشان جدا شوند و الکتریسیته را درون شبکه و درنتیجه کل ماده منتقل کنند.
فلزات، گرافیت و برخی ترکیبات شیمیایی متعلق به این گروه هستند. اما مواد رسانای گروه دوم، الکترولیتهایی هستند که یونها، بار الکتریکی را درون آنها منتقل میکنند. انتقال بار الکتریکی درون الکترولیتها همواره به حرکت یونها وابسته است. یونیزاسیون (Ionization) معمولا از طریق حل کردن یک ماده در یک حلال قطبی (مانند آب) و یا ذوب کردن اتفاق میافتد.
فرمول هدایت الکتریکی یا کنداکتیویتی
بر اساس قانون اهم، ولتاژ V اعمال شده به یک محلول با جریان الکتریکی عبوری از آن متناسب است. مقاومت (R) ثابت تناسب در این رابطه است. مقدار مقاومت را میتوان با اندازهگیری مقدار جریان عبوری از محلول و با فرض مشخص بودن ولتاژ اعمالی میتوان محاسبه کرد. کندوکتانس (G) نیز معکوس مقاومت و واحد آن زیمنس است.
برای اندازهگیری مقاومت یا کندوکتانس یک محلول به یک واحد اندازهگیر (measuring cell) نیاز داریم. این سلول یا واحد اندازهگیری از حداقل دو الکترود رسانا با بار مخالف تشکیل شده است. این دو الکترود با همدیگر یک واحد اندازهگیری را تشکیل میدهند و همراه با بدنه به یک سنسور هدایت سنج تبدیل میشوند.
البته اندازهگیری کندوکتانس به هندسه سلول اندازهگیری نیز وابسته است که با ثابت سلول K توصیف میشود. در واقع ثابت K برابر با نسبت فاصله دو الکترود (l) به سطح مقطع موثر الکترولیت بین الکترودها (A) است. کندوکتانس را میتوان به کنداکتیویتی تبدیل کرد که مستقل از هندسه سلول است. برای این کار باید کندوکتانس را در ثابت سلول ضرب کرد.
K = G * (L/A) = G * K
رزیستیویتی نیز معکوس کنداکتیویتی و دارای واحد Ω.cm است و با رابطه زیر محاسبه میشود:
ρ = 1 / K
کنداکتیویتی محلولها
اکثر محلولهای خالص نارسانا هستند و کنداکتیویتی نزدیک صفر دارند. اما ذرات حلشده با پیوندهای یونی یا بسیار قطبی از هم گسسته و منجر به هدایت الکتریکی محلول میشوند. تاثیر یونهای حلشده را در ادامه مفصل مورد بحث قرار میدهیم. با این حال، آب نیز به مقدار کمی به یونها تجزیه (Dissociation) میشود، در نتیجه حتی آب خالص نیز مقداری کنداکتیویتی دارد.
یونهای محلول
به تجزیه مواد که یونها را تشکیل میدهد، تفکیک یا تجزیه الکترولیتی (electrolytic dissociation) میگویند. برخی از تفکیکهای الکترولیتی در زیر نشان داده شدهاند.
NaCl → Na+ + Cl–
HCl → H+ + Cl–
CH3COOH → CH3COO– + H+
بین یک الکترولیت قوی و یک الکترولیت ضعیف تفاوتهایی وجود دارد. الکترولیتهای قوی مانند سدیم کلراید و هیدروکلریک اسید به صورت کامل برای تشکیل یونهای سدیم و کلرید و یا پروتون و یونهای کلرید تجزیه میشوند. در مقابل، الکترولیتهای ضعیف مانند استیک اسید تنها تا حدی تجزیه میشوند که به این معنی است که محلول الکترولیت حاوی استات یونی (–CH3COO) و پروتون (+H) و همچنین مولکولهای غیر یونی اسید استیک (CH3COOH) است.
فرایند تجزیه به شدت به دما وابسته است و میتوان آن را با یک ثابت تفکیک کمیسازی کرد. فقط بخش یونی جدا شده به رسانایی کمک میکند. سهم یک یون در رسانایی به غلظت، بار و تحرک آن در حلال بستگی دارد. رسانایی یک نمونه را میتوان به عنوان تابعی از غلظت یونهای محلول و خواص الکتروشیمیایی آنها بیان کرد:
K = ∑i CiZiλi
در رابطه فوق، C غلظت یونها، Z عدد بار یون یا والانس (ion charge number) و λ کندوکتانس یونی معادل (equivalent ionic conductance) است.
کندوکتانس یونی معادل
کندوکتانس یونی معادل یک ویژگی خاص برای هر نوع یون است. نه تنها به نوع یون، بلکه به غلظت و دما نیز بستگی دارد. در جدول زیر کندوکتانس یونی معادل یونهای مختلف آورده شده است.

کندوکتانس یونی معادل معمولا با والانس افزایش و با اندازه کاهش مییابد. با این حال، مقدار پیشبینی شده ممکن است با مقدار واقعی اندازهگیری شده در جدول بالا متفاوت باشد. به عنوان مثال، کنداکتیویتی یون کوچک لیتیوم بسیار کمتر از یون بزرگ آمونیوم است. این امر به این دلیل است که سایز یون حلشده، نه سایز خود یون، فاکتور تعیین کننده در میزان تحرک است. یک یون کوچکتر با بار بزرگ مانند لیتیوم میتواند مولکولهای آب بیشتری را جذب کند و solvation shell بزرگتری نسبت به یک یون بزرگتر با بار کوچکتر بسازد.
رسانایی بسیار بالای یک پروتون (+H) و یون هیدروکسید (–OH) نیز قابل توجه است. مکانیسم انتقال این دو یون بر اساس مهاجرت یونی نیست. پروتونها به راحتی از هیدرونیوم (+H3O) به اطراف H2O یا از H2O به هیدروکسید (–OH) منتقل میشوند. بار عمدتاً توسط مبادله سریع الکترون منتقل میشود و نه از طریق مهاجرت کندتر یونها. به همین دلیل، اسیدها و بازها بسیار رساناتر از نمکها هستند که میتواند در درک اهمیت مقادیر رسانایی در بسیاری از کاربردها مهم باشد.
عوامل موثر بر کندوکتانس
همان طور که قبلا ذکر شد، کندوکتانس معادل، یک مقدار ثابت نیست. با افزایش غلظت، کندوکتانس یونی معادل کاهش مییابد. زیرا تداخل فزایندهای در حرکت یونها در جهت مخالف به وجود میآید. در مورد الکترولیتهای ضعیف نیز رسانایی به دلیل نرخ تجزیه کمتر در غلظتهای بالاتر کاهش مییابد.
دما نیز بر کندوکتانس یونی معادل تأثیر میگذارد. دمای بالاتر باعث افزایش حرکت ذرات و کاهش ویسکوزیته حلال میشود. این امر منجر به افزایش تحرک یونها و هدایت بالاتر میشود. از آنجا که ویسکوزیته یکی از ویژگیهای حلال است، تحرک همه یونها تمایل به افزایش یکسانی با دما دارد که جبران دما را برای اندازهگیریهای عمومی ساده میکند. با این حال، در مورد الکترولیتهای ضعیف، دمای بالاتر ممکن است میزان تجزیه را تغییر دهد و بنابراین بر هدایت الکتریکی تاثیر بگذارد. این امر جبران دما را پیچیده میکند.
پس به طور خلاصه میتوان گفت، رسانایی یک محلول به پارامترهای مختلفی بستگی دارد که گاهی اوقات برهم کنش دارند. عوامل موثر مهم بر رسانایی را میتوان به شرح زیر خلاصه کرد:
- نوع الکترولیت محلول (بار یونی، شعاع یونی، تحرک یونی)
- غلظت الکترولیت محلول
- درجه تجزیه الکترولیت
- حلال (ویسکوزیته)
- درجه حرارت
تجزیه (Dissociation) آب
همان طور که قبلا هم اشاره کردیم، آب خالص بدون وجود هیچ ناخالصی، در دمای ۲۵ درجه سانتیگراد، دارای هدایت الکتریکی در حدود ۰.۰۵۵ میکروزیمنس بر سانتیمتر و مقاومت ۱ مگا اهم در سانتیمتر است. این مقدار کم کنداکتیویتی به دلیل وجود یونهای هیدرونیم (+H3O) و هیدروکسید (–OH) است که در فرایند تجزیه آب به وجود آمدهاند. در تصویر زیر تجزیه آب خالص نشان داده شده است.
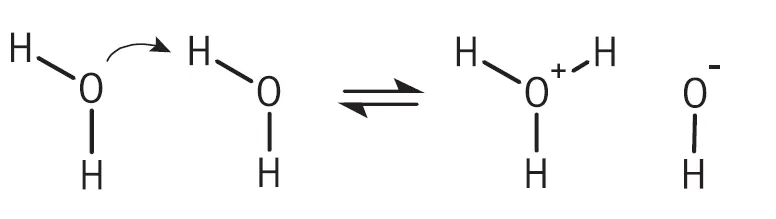
تعادل این تجزیه به شدت در سمت آب است و تنها دو مولکول آب از یک میلیارد مولکول به شکل یونی در میآیند. تاثیر این تجزیه در اندازهگیریهای کاربردهای عمومی بسیار ناچیز است، اما در مورد آب خالص غالب است. درجه تفکیکپذیری آب به شدت به دما وابسته است. به همین دلیل در اندازهگیری کنداکتیویتی آب خالص باید به جبرانسازی دما توجه بسیار بیشتری نمود.
روش اندازهگیری هدایت الکتریکی
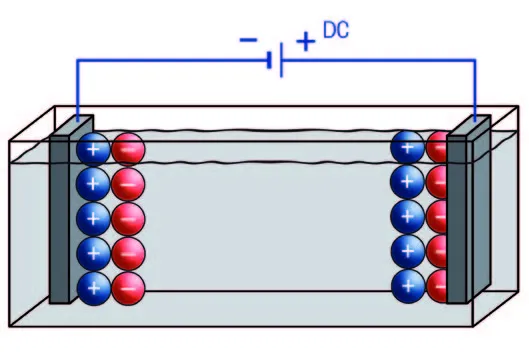
یک سلول اندازهگیری کنداکتیویتی یا هدایت سنج یا کنداکتیوتی متر از یک جفت الکترود تشکیل شده است که به آنها ولتاژ اعمال میشود. سپس جریان مدار تشکیل شده توسط هدایت سنج یا ecمتر اندازهگیری میشود و بر اساس قانون اهم و فرمول کنداکتیوتی بخش قبل مقدار کنداکتیوتی محاسبه میشود. این توضیح ساده شده طرز کار هدایت سنج برای اندازهگیری هدایت الکتریکی است. زمانی که یک ولتاژ DC به الکترودها اعمال میشود، یونهای با بار مثبت (کاتیون) به سمت الکترود با بار منفی یا کاتد و یونهای منفی (آنیون) به سمت الکترود مثبت یا آند حرکت میکنند. این مفهوم در تصویر زیر نشان داده شده است.

پلاریزاسیون
این پدیده منجر به تجمع یونها نزدیک سطح الکترود میشود و شرایطی را به وجود میآورد که به آن پلاریزاسیون (polarization) میگویند که منجر به وقوع واکنشهای شیمیایی میشود. این الکترولیز بر ترکیبات محلول و در نتیجه میزان هدایت الکتریکی آن نیز تاثیر میگذارد. برای جلوگیری از پلاریزاسیون نامطلوب و واکنشهای الکترولیز، از ولتاژ AC برای اندازهگیری کنداکتیوتی در ECمترها استفاده میشود. اگر از جریان متناوب یا AC در هدایت سنج بهره بگیریم، یونها فقط در یک جهت حرکت نمیکنند. بلکه متناسب با ریتم فرکانس اعمالی، در موقعیت خود نوسان میکنند. تفاوت بین استفاده از ولتاژ AC و DC در هدایت سنج در تصاویر زیر نشان داده شده است.

حتی زمانی که از جریان AC در هدایت سنج استفاده میکنیم نیز تجمع یونها به صورت کامل از بین نمیرود. تمام تاثیراتی ناشی از تجمع یونها در مرز بین سطح الکترود و محلول هنگام اعمال ولتاژ را به صورت خلاصه پلاریزاسیون میگویند. مهمترین تاثیر، تشکیل یک لایه دوگانه یونها است که از تحرک یونها در نزدیکی سطح الکترودها جلوگیری میکند. تاثیر این لایه همانند تاثیر آلودگی الکترودها است و منجر به افزایش مقاومت الکتریکی محلول میشود. در نتیجه پلاریزاسیون بر اندازهگیری کنداکتیویتی محلولهای با غلظت الکترولیت متوسط تا بالا تاثیر منفی میگذارد و همانند تصویر زیر، خطی بودن نتایج را در محدوده بالای بازه اندازهگیری کاهش میدهد.

رفع اثر پلاریزاسیون
برای کاهش اثر پلاریزاسیون میتوان اقدامات زیر را انجام داد:
- تنظیم فرکانس اندازهگیری: هرچه فرکانس اندازهگیری بالاتر باشد، یونها زمان کمتری برای تجمع در نزدیکی الکترودها و تشکیل لایه دارند. پس استفاده از فرکانس اندازهگیری بالا پلاریزاسیون را کمینه میکند.
- بهینهسازی سطح الکترودها: با ناهموار کردن سطح الکترودها، سطح آنها افزایش، چگالی جریان کاهش و در نتیجه پلاریزاسیون کاهش مییابد.
- استفاده از هدایت سنج یا ECمتر با چهار الکترود: کنداکتیویتمترهای چهار الکترودی کمتر تحت تاثیر پلاریزاسیون قرار میگیرند.
اثر خازنی
همان طور که در تصویر فوق نیز مشخص است، خطی بودن در محدوده پایین بازه اندازهگیری توسط اثر خازنی محدود میشود. دو الکترود در یک واسط نارسانا مانند خازن عمل میکنند. زمانی که یک ولتاژ DC به این الکترودها اعمال میشود، هیچ جریانی عبور نمیکند. امپدانس بسیار بالا و کندوکتانس صفر است. اما اگر ولتاژ AC به الکترودها اعمال شود، امپدانس افت میکند و کندوکتانس افزایش مییابد.
نکته مهم دیگر در اندازهگیری کنداکتیویتی سیالات در فرایندهای صنعتی این است که کابل بلندی که سنسور را به تجهیز اندازهگیر متصل میکند، باعث افزایش مقدار ظرفت خازنی به قابل توجهی میشود.
رفع اثر خازنی
اثر خازنی را میتوان با روشهای زیر کاهش داد:
- تنظیم فرکانس اندازهگیری: هر چقدر فرکانس اندازهگیری کمتر باشد، تاثیر خازنی کمتر میشود.
- استفاده از یک هدایت سنج با اثر خازنی پایین: هر چقدر سطح الکترودها کوچکتر و فاصله آنها از هم بیشتر باشد، مقدار اثر خازنی کاهش مییابد. البته این روشی عملی نیست. زیرا برای اندازهگیری در محدوده کنداکتیویتی کوچک، به سلول با ثابت کوچک (سطح الکترود بزرگ و فاصله کم بین الکترودها) نیاز است تا مقاومت به اندازه کافی پایین باشد و اندازهگیری قابلیت اطمینان بالایی داشته باشد.
- طراحی مدارات دقیقتر: طراحیهای مناسب هدایت سنج یا کنداکتیویتیمتر با کنترل دقیق سیگنالها میتواند اثر خازنی کابل را کاهش دهد.
- استفاده از سنسور دیجیتال: با وجود مدارات اندازهگیری و مبدل آنالوگ به دیجیتال در داخل سنسور، مسافت بسیار ناچیزی برای انتقال سیگنال AC اندازهگیری باقی خواهد ماند. بنابراین اثر خازنی کابل حذف میشود. فقط یک سیگنال دیجیتال مقاوم با کابل به ترنسمیتر منتقل میشود.
تنظیم فرکانس اندازهگیری
فرکانس اندازهگیری بهینه به بازه اندازهگیری بستگی دارد. بنابراین، فرکانس با کنداکتیویتی محلول تطبیق مییابد. در حالت کلی، فرکانسهای پایین برای مقادیر کنداکتیویتی کم اعمال میشود که اثرات پلاریزاسیون ناچیز است اما اثر خازنی مشکلساز است. از طرف دیگر، فرکانسهای بالا برای محلولهای با مقادیر هدایت الکتریکی بزرگ مورد استفاده قرار میگیرد تا اثر پلاریزاسیون کاهش داده شود.
مدارات اندازهگیری کنداکتیویتی مدرن فرکانس اندازهگیری و ولتاژ را به صورت اتوماتیک و بر اساس بازه اندازهگیری تنظیم میکنند.الگوریتمهای مورد استفاده برای این تنظیمات در سازندگان مختلف، متفاوت است. به همین دلیل مشخصههای باز اندازهگیری در هدایت سنجهای مختلف متفاوت هستند.
کنداکتیویتی متر یا هدایت سنج پریسماتک
شرکت پریسماتک تولید کننده کنداکتیویتی مترهای اینلاین و آزمایشگاهی است. اگر قصد خرید کنداکتیویتی متر دارید، میتوانید با شمارههای شرکت تماس بگیرید تا همکاران ما اطلاعات فنی محصولات را به شما ارائه دهند.
هدایت سنج یا ECمتر اینلاین PTCond
هدایت سنج یا ECمتر آزمایشگاهی BPTCond
در این مطلب به بررسی مفهوم هدایت الکتریکی یا کنداکتیویتی پرداختیم. اگر این مطلب برای شما مفید بود، شاید به مطالب زیر نیز علاقهمند باشید:
کنداکتیویتیمتر ــ به زبان ساده
نحوه کار با هدایت سنج یا ecمتر چگونه است؟
عیبیابی کنداکتیویتی متر ــ راهنمای کاربردی
انواع هدایت سنج یا کنداکتیومتر
پریسماتک اولین تولیدکننده رفرکتومتر، فلومتر و کنداکتیویتیمترهای صنعتی در انواع مختلف است. برای راهنمایی در انتخاب این ابزارها با شماره های شرکت تماس بگیرید.
محصولات پریسماتک:








